
Классификация, взаимосвязь и закономерность — три «слона», на которых зиждутся многие точные и неточные науки, а открытие Дмитрия Менделеева стало вершиной эффективного и доступного метода деления вещей и понятий. Разбираемся в структуре таблицы Менделеева и раскладываем все «по полочкам», чтобы досконально понять, как она устроена и как ей пользоваться.
Что такое периодическая система химических элементов Менделеева
Все, что нас окружает, живое или неживое, состоит из химических элементов, а те — из атомов. От того, как последние устроены, сколько в них частиц (нейтронов и протонов), каков заряд их ядра, зависят свойства элементов, собранных в таблице Менделеева. Она названа именем своего первооткрывателя — Дмитрия Ивановича Менделеева. Именно этот русский ученый 1869 году установил, что свойства элементов и их атомные массы связаны определенной зависимостью, которая и легла в основу периодической таблицы. Интересно, что величайшее научное открытие, совершившее переворот в изучении химии, сделал человек, который был младшим, 17-м по счету ребенком в семье сибирского фабриканта. По словам Олега Писаржевского, написавшего биографическую книгу о Менделееве, ученый работал над таблицей и одноименным законом «почти сорок лет, находя все новые и новые подтверждения своему открытию, уточняя и углубляя его» (1).
История открытия периодического закона
Закон, открытый Менделеевым, устанавливает периодическое изменение свойств химических элементов в зависимости от изменения зарядов атомных ядер. После его появления химия перестала быть наукой описательного характера. Многие химики еще до Менделеева пробовали хоть как-то упорядочить элементы и связать атомную массу со свойствами элементов. Но открыть фундаментальный закон химии удалось только Дмитрию Ивановичу. Случилось это во время написания учебника «Основы химии».
Работая над поиском закономерности, в качестве аргумента ученый избрал массу элемента, измеряемую непосредственно атомным весом. Он поставил цель — найти функциональную связь между атомными весами элементов и их особенностями. Свой закон Менделеев изначально решил увязать с такими химическими понятиями, как атом, атомный вес и атомность (валентность) (2).
Рукопись с таблицей, названной впоследствии именем автора, Менделеев сдал в печать 17 февраля 1869 года. Работа называлась «Опыт системы элементов, основанной на их атомном весе и химическом сходстве». Ученый доказал, что свойства элементов по мере роста атомной массы изменяются не плавно, а периодически. На фундаменте проделанной работы Менделеев вскоре вывел периодический закон, на котором и зиждется таблица, вернее, она была ее графическим выражением. Ранее во многих ее клетках была пустота, но Менделеев был твердо убежден, что когда-нибудь они будут заполнены. И не ошибся. Уже спустя 15 лет после формулировки закона были открыты сразу три элемента, в существовании которых был уверен ученый, — Ga, Sc, Ge. Закон работал!
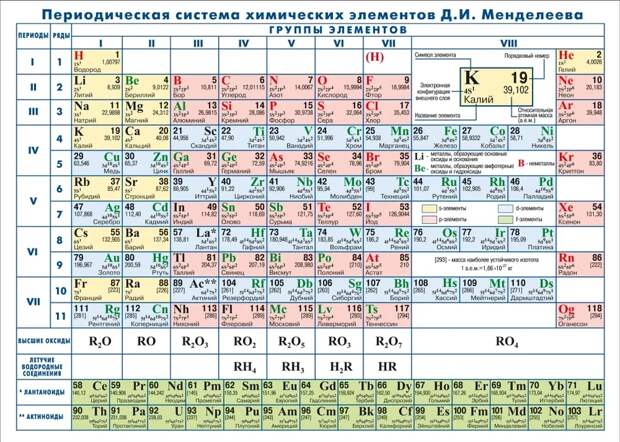
Структура таблицы Менделеева
В таблице имеется множество клеточек, и в каждую вписан один элемент. В ней также легко заметить разделение — на периоды и группы. Все вещества выстроены в строгой последовательности: слева направо идет возрастание роста их атомных масс. Часто в таблице используется цветовая заливка, она помогает ориентироваться в ее структуре и группирует элементы по их свойствам.

Но почему таблицы Менделеева выглядят по-разному — они бывают цветные и черно-белые, отличаются размерами и обозначениями. С этим вопросом мы обратились к кандидату химических наук, старшему научному сотруднику лаборатории материалов и процессов водородной энергетики Физико-технического института им. А. Ф. Иоффе Кириллу Мартинсону.
— Визуализация таблицы Менделеева зависит от использования различных систем нумерации и классификации элементов, от того, на какие свойства выбирается фокус, — отметил эксперт. — В одних случаях акцентируется внимание на электронных оболочках и распределении электронов, в других — выделяются элементы с особыми свойствами, например благородные газы, переходные металлы или редкоземельные элементы.
Периоды
Периодами называют горизонтальные строчки. Их всего семь. Элементы, объединенные одним периодом, обладают одинаковым числом энергетических уровней, на которых имеются электроны.
В пределах одного периода, с возрастанием порядкового номера, просматриваются следующие закономерности:
- растет электроотрицательность;
- уменьшаются металлические свойства, а неметаллические растут;
- становится меньше атомный радиус — в таблице есть малые и большие периоды.
В малых периодах содержится мало элементов — это I, II и III периоды. В первом — два элемента, во втором и третьем — по восемь элементов. Остальные периоды большие: в IV и V по 18 элементов, в VI — 32, в VII — 24. Внизу таблицы имеются еще две строчки — с лантаноидами и актиноидами (VI и VII соответственно).
В таблице всего десять рядов, в малых периодах — по одному ряду, в остальных — по два. Из больших — только в VII периоде содержится один ряд.
Группы
Группы расположены вертикально (в столбцах), причем в пределах каждой из них у элементов наблюдаются схожие свойства. С возрастанием атомного числа последние меняются в соответствии с определенной закономерностью. Всего в таблице 18 групп. Отсчет идет с левой стороны направо.
| № группы | Название группы/подгруппы (п/г) |
| 1 | щелочные металлы |
| 2 | щелочноземельные металлы |
| 3 | п/г скандия |
| 4 | п/г ванадия |
| 5 | п/г титана |
| 6 | п/г хрома |
| 7 | п/г марганца |
| 8 | п/г железа |
| 9 | п/г кобальта |
| 10 | п/г никеля |
| 11 | п/г меди |
| 12 | п/г цинка |
| 13 | п/г бора |
| 14 | п/г углерода |
| 15 | п/г азота |
| 16 | п/г кислорода |
| 17 | галогены |
| 18 | инертные газы |
Элементы, входящие в одну группу, показывают изменение свойств (если двигаться сверху вниз):
- растет радиус атома;
- металлические свойства становятся более выраженными, а неметаллические, наоборот, слабеют;
- уменьшается электроотрицательность (способность атомов притягивать электроны).
Группы пронумерованы арабскими цифрами, но может быть использована и римская нумерация с добавлением букв А и Б.
Элементы
Во времена Менделеева таблица была далека от полного заполнения. Так, например, ученые не подозревали о наличии благородных (инертных) газов. Правда, незадолго до эпохального открытия стали говорить о каком-то странном элементе: ученые именовали его «солнечный газ». Это был гелий, который открыли почти через 30 лет. Благодаря таблице удалось предвидеть открытие других веществ. Так, сам Менделеев утверждал, что в природе есть эка-алюминий, эка-кремний и эка-бор (3), которые сегодня называются галлий, скандий и германий соответственно.
На сегодня в таблице собрано 118 элементов. В 2000-е годы туда добавили теннессин (№117) и оганесон (№ 118). Сейчас идут активные исследования по поиску 119-го элемента. Он еще не найден, но уже получил название, вернее даже два — унуненний или эка-франций.
Химические элементы от водорода до урана, имеющего 92-й номер (у него 92 протона и столько же электронов), встречаются в природе. Все элементы начиная с нептуния, идущего под 93-м номером, имеют искусственное происхождение: ученые создали их в лабораторных условиях.
Свойства таблицы Менделеева
Периодическая таблица не сразу получила признание, но впоследствии именно благодаря ей Менделеев стал самым известным в мире русским ученым. Уникальная систематизация элементов, представленная в табличном выражении, обладает рядом свойств, позволяющим эффективно пользоваться ею при решении самых разных химических задач.
- Изменение атомного радиуса происходит с определенной закономерностью. Причем в группах и периодах она разная. Во-первых, рост наблюдается сверху вниз, а во-вторых, уменьшение происходит слева направо. На внешнем уровне при этом растет число электронов, они интенсивнее притягиваются к ядру, и атомы будто «сжимаются».
- Закономерное изменение металлических и неметаллических свойств, которое выражается в способности отдавать и захватывать электроны соответственно. Чем более удален электрон от ядра и чем меньше их число на крайней орбите, тем легче происходит отдача. В периодах рост металлических свойств происходит справа налево, а в группах — сверху вниз. С неметаллическими же свойствами все ровно наоборот — в группах усиление идет снизу вверх, а в пределах периодов — с левой стороны направо.
- Изменение основных и кислотных свойств. Первые проявляются у металлов, последние — у неметаллов. Изменение происходит по аналогии со свойствами металлов и неметаллов.
Таблица Менделеева кажется абсолютно уникальным и даже совершенным творением научной мысли. Но Кирилл Мартинсон считает, что некорректно использовать понятие «совершенство» в вопросах, касающихся интерпретации фундаментальных законов природы.
— Периодическая таблица не является статичным и неизменным инструментом, — подчеркивает эксперт, — это динамическая модель, развивающаяся вместе с прогрессом науки. Ученые неоднократно вносили в нее изменения и дополнения, отражая новые открытия и углубленное понимание структуры атомов.
Как правильно читать таблицу Менделеева
В ячейках таблицы находится важная информация об элементах, которые их занимают. Несмотря на краткость, она полностью раскрывает особенности всех веществ и позволяет предвидеть их «поведение» в той или иной ситуации.
- Порядковый номер. Он может располагаться вверху, по центру или в углу. Самый маленький номер — 1, самый большой — 118.
- Название. В таблице может указываться полное название вещества или только химический символ, который состоит из 1—2 латинских букв.
- Массовое число. Под ним понимают общее число нейтронов и протонов в атомном ядре. Его легко определяют по атомной массе, округляя до целых чисел. В нижней части клеток — атомная масса (сумма масс протонов и нейтронов). Ее значение представлено обычно как десятичная дробь.
По таблице также легко определяется валентность вещества, отражающая способность элементов образовывать химические связи.
Примеры задач на работу с таблицей Менделеева
Посредством таблицы решают самые разные химические задачи. Рассмотрим пару примеров использования периодической системы Менделеева при решении элементарных заданий.
Задача № 1
Определите, сколько протонов и нейтронов имеется в составе ядра кислорода с массовым числом 18.
Смотрим в таблицу Менделеева, находим там кислород. Обычный кислород имеет атомную массу 16. Порядковый номер кислорода — 8, значит, ядро его радиоактивного изотопа, имеющего массовое число 18, содержит 8 протонов и 10 нейтронов.
Задача № 2
Пользуясь периодической таблицей, определите количество нейтронов в ядре бора с массовым числом 11.
Решение:
Количество нейтронов равняется разности массового и зарядового (атомного) числа. Последнее определяется порядковым номером. Смотрим в таблицу, атомный номер бора — 5. Таким образом, количество нейтронов находим как 11 – 5 = 6.

Комментарий эксперта
О существовании таблицы Менделеева знает каждый, кто ходил в школу, при этом одни люди пользуются ею каждый день, другие совершенно не умеют ее «читать». Вместе с тем есть вещи, которые должен знать любой человек, о них мы и поговорили с Кириллом Мартинсоном.
 — Человеку, который по сфере своей деятельности не имеет прямого отношения к физике или химии, таблица Менделеева, конечно, не будет приносить прямой практической пользы, — считает эксперт. — Но понимание общих законов природы важно для каждого, поскольку это способствует более осознанному восприятию мира.
— Человеку, который по сфере своей деятельности не имеет прямого отношения к физике или химии, таблица Менделеева, конечно, не будет приносить прямой практической пользы, — считает эксперт. — Но понимание общих законов природы важно для каждого, поскольку это способствует более осознанному восприятию мира.Кирилл Мартинсон рассказал, что существуют таблицы Менделеева с различными способами представления периодичности свойств элементов. Встречаются спиральные, круговые или трехмерные версии, позволяющие подчеркнуть определенные свойства элементов или их взаимосвязи.
— Все естественно встречающиеся на Земле элементы уже открыты, но исследования в области синтеза новых сверхтяжелых элементов, которые характеризуются крайне нестабильными ядрами, продолжаются, — констатирует Кирилл Мартинсон. — Они распадаются на другие элементы в течение долей секунды после своего образования. Их синтез требует сложных технологий и высокоэнергетических установок, таких, например, как ускорители частиц.
Вопрос о том, существует ли «последний» элемент, остается открытым:
— Теоретически существование элементов с еще большими атомными номерами возможно, но с увеличением заряда ядра атома уменьшается их стабильность. Существуют особые области в периодической таблице — «острова стабильности», где сверхтяжелые элементы могли бы иметь относительную стабильность, но практическое подтверждение этого пока не достигнуто.
Что нужно запомнить о периодической системе химических элементов Менделеева
Периодическая система Менделеева дала мощный импульс развитию химической науки. С ее открытием ученые смогли вести исследования с целью обнаружения новых элементов и выявления ранее неизвестных свойств. Таблица установила закономерность и связи между элементами и их свойствами. Она способствовала обнаружению элементов, о существовании которых ранее ученые даже не подозревали.
1. В периодах/группах характеристики элементов меняются в определенной закономерности. Увеличиваются или уменьшаются свойства металлического и неметаллического характера, усиливается или ослабевает способность элементов к вступлению в реакции.
2. По положению элемента в таблице/группе/периоде можно установить его принадлежность к металлам/неметаллам, валентность и прочие особенности. Достаточно взглянуть на ячейку и ее положение в таблице, чтобы получить максимум информации об элементе.
Список источников:
- Писаржевский О. Дмитрий Иванович Менделеев. 1949.
- Семишин В. Периодический закон Менделеева в работах русских ученых. 1959.
- Белопухов Л. Д. И. Менделеев и периодическая система элементов. Научно-популярный физико-математический журнал «Квант» № 5. 2019.
Эксперт: Кирилл Мартинсон, кандидат химических наук, старший научный сотрудник лаборатории материалов и процессов водородной энергетики Физико-технического института им. А. Ф. Иоффе
Свежие комментарии